Hoạt động mở đầu (trang 53) SGK Hóa 10 Cánh diều Bài 10: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
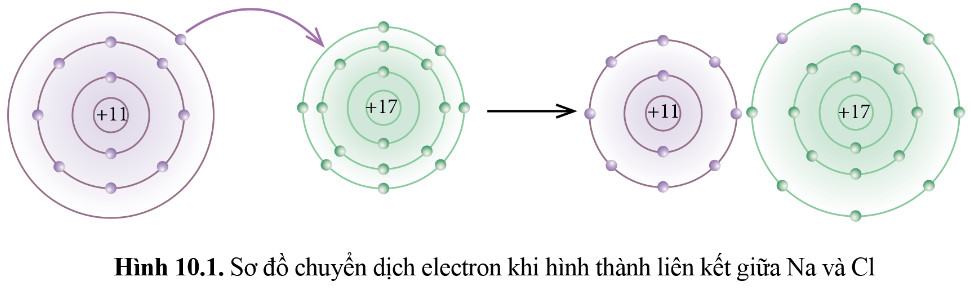
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion
Trả lời:
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1
I. Khái niệm và sự hình thành liên kết ion
1. Khái niệm
Câu hỏi 1 (trang 53) SGK Hóa 10 Cánh diều Bài 10: Phát biểu nào sau đây là đúng?
A. Liên kết ion chỉ có trong đơn chất.
B. Liên kết ion chỉ có trong hợp chất.
C. Liên kết ion có trong cả đơn chất và hợp chất.
Đáp án: B. Liên kết ion chỉ có trong hợp chất.
Luyện tập 1 (trang 54) SGK Hóa 10 Cánh diều Bài 10: Hãy nêu một số hợp chất ion:
a) Tạo nên bởi các ion đơn nguyên tử.
b) Tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử.
c) Tạo nên bởi các ion đa nguyên tử.
Lời giải:
a) Hợp chất ion tạo nên bởi ion đơn nguyên tử: NaCl, KF, BaCl2 ….
Na+ + Cl- → NaCl
K+ + F- → KF
Ba2+ + 2Cl- → BaCl2
b) Hợp chất ion tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử: NaNO3; K2SO4; CaCO3; NH4Cl …
Na+ + NO3- → NaNO3
2K+ + SO42- → K2SO4
Ca2+ + CO32- → CaCO3
NH4+ + Cl- → NH4Cl
c) Tạo nên bởi các ion đa nguyên tử
2NH4+ + SO42- → (NH4)2SO4
NH4+ + NO3- → NH4NO3
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
Câu hỏi 2 (trang 54) SGK Hóa 10 Cánh diều Bài 10: Viết hai giai đoạn của sự hình thành CaO từ các nguyên tử tương ứng (kèm theo cấu hình electron)
Trả lời:
- Phân tử CaO gồm 2 nguyên tố: Ca và O
+ Cấu hình electron Ca: 1s22s22p63s23p64s2
+ Cấu hình electron O: 1s22s22p4
Giai đoạn 1: Hình thành ion Ca2+ và O2-
Ca → Ca2+ + 2e
Cấu hình electron: 1s22s22p63s23p64s2 → 1s22s22p63s23p6 + 2e
O + 2e → O2-
Cấu hình electron: 1s22s22p4+ 2e → 1s22s22p6
Giai đoạn 2: Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng không.
Ca2+ + O2- → CaO
Nhận xét: Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình
Luyện tập 2 (trang 54) SGK Hóa 10 Cánh diều Bài 10: Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (tạo nên từ một loại cation và một loại anion) có thể được tạo thành từ các ion đã cho. Biết rằng tổng điện tích của các ion trong hợp chất bằng 0.
Lời giải:
Công thức các hợp chất ion có thể tạo thành là: LiF, Li2O, Li3PO4, CaF2, CaO, Ca3(PO4)2, AlF3, Al2O3, AlPO4.
Li+ + F- → LiF
2Li+ + O2- → Li2O
3Li+ + PO43- → Li3PO4
Ca2+ + 2F- → CaF2
Ca2+ + O2- → CaO
3Ca2+ + 2PO43- → Ca3(PO4)2
Al3+ + 3F- → AlF3
2Al3+ + 3O2- → Al2O3
Al3+ + PO43- → AlPO4
Luyện tập 3 (trang 54) SGK Hóa 10 Cánh diều Bài 10: Cho các chất sau: SiO2 là thành phần chính của thạch anh, CaCO3 là thành phần của đá vôi. Hãy cho biết chất nào được tạo nên bởi liên kết ion? Giải thích
Trả lời:
- CaCO3 được tạo bởi liên kết ion.
II. Tinh thể inon
1. Khái niệm
Thí nghiệm 1 (trang 55) SGK Hóa 10 Cánh diều Bài 10: Lắp ráp mô hình tinh thể NaCl: Quan sát Hình 10.2b để lắp ráp mô hình tinh thể NaCl từ các quả cầu minh họa cho Na+, Cl- và que nối
Kết quả:
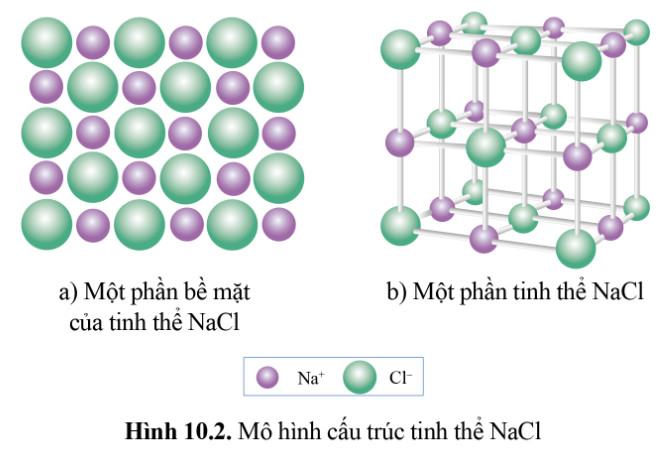
Thí nghiệm 2 (trang 55) SGK Hóa 10 Cánh diều Bài 10: Từ mô hình NaCl, hãy cho biết xung quanh mỗi ion Na+ có bao nhiêu ion Cl- (ở gần nhất với Na+)?
Kết quả:
Từ mô hình NaCl, có thể thấy được xung quanh mỗi ion Na+ có 6 ion Cl-
2. Đặc điểm của hợp chất ion
Vận dụng (trang 55) SGK Hóa 10 Cánh diều Bài 10: Hãy kể tên một số hợp chất ion có xung quanh em và cho biết trong điều kiện thường, chúng tồn tại ở thể nào.
Lời giải:
- Một số hợp chất ion có xung quanh em:
+ NaCl (muối ăn) điều kiện thường tồn tại ở thể rắn.
+ CaO (vôi sống) điều kiện thường tồn tại ở thể rắn.
+ CaCO3 (đá vôi) điều kiện thường tồn tại ở thể rắn.
Bài tập
Bài tập 1 (trang 56) SGK Hóa 10 Cánh diều Bài 10: Những phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất
(a) cộng hóa trị
(b) ion
(c) có công thức Al2O3
(d) có công thức Al3O2
Đáp án: B, C
Bài tập 2 (trang 56) SGK Hóa 10 Cánh diều Bài 10: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao
(c) Thường tồn tại ở thể rắn trong điều kiện thường
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp
Lời giải:
- Đặc điểm hợp chất ion:
+ Các hợp chất ion thường là tinh thể rắn ở điều kiện thường
+ Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao
=> Phát biểu (b) và (c) đúng
Bài tập 3 (trang 56) SGK Hóa 10 Cánh diều Bài 10:
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
b) Vì sao cả Na2O và MgO đều là chất rắn ở điều kiện thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Lời giải:
a) Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng, có xu hướng nhường 1, 2, 3 electron này để đạt cấu hình bền vững giống như khí hiếm. Khi nhường electron các ion kim loại mất đi 1 lớp electron ngoài cùng. Do đó bán kính ion kim loại nhỏ hơn bán kính nguyên tử kim loại tương ứng.
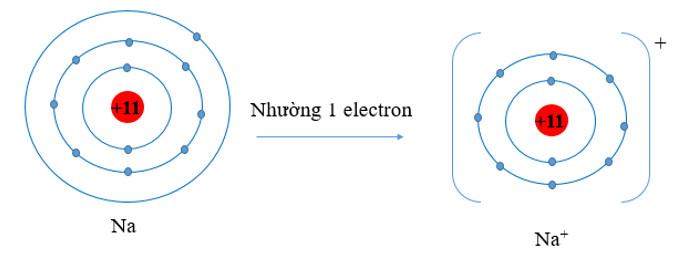
- Nguyên tử Na có 3 lớp electron, 1 electron lớp ngoài cùng. Nguyên tử Na đã nhường đi 1 electron ở lớp thứ 3 để trở thành ion Na+. Khi đó ion Na+ chỉ còn 2 lớp electron
⇒ Bán kính Na+ nhỏ hơn bán kính nguyên tử Na.
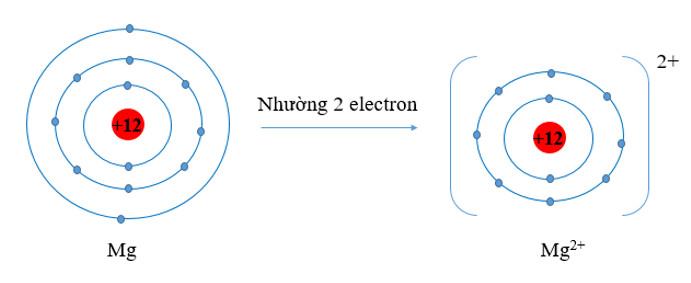
- Nguyên tử Mg có 3 lớp electron, 2 electron lớp ngoài cùng. Nguyên tử Mg đã nhường đi 2 electron ở lớp thứ 3 để trở thành ion Mg2+. Khi đó ion Mg2+ chỉ còn 2 lớp electron
⇒ Bán kính Mg2+ nhỏ hơn bán kính nguyên tử Mg2+.
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c) Ta có:
+ Bán kính ion Na+ > bán kính ion Mg2+
+ Điện tích ion Mg2+ > điện tích ion Na+
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.
