Mở đầu
Hoạt động mở đầu (trang 16) SGK Hóa 10 Cánh diều Bài 3: Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học
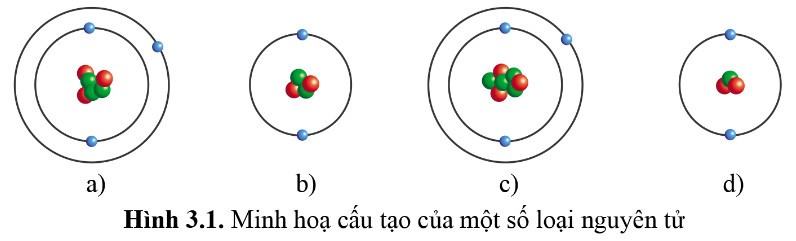
Trả lời:
- Những nguyên tử mà hạt nhân có cùng số proton sẽ thuộc cùng một nguyên tố hóa học.
- Trong một nguyên tử trung hòa về điện, số hạt proton = số hạt electron
- Dễ dàng thấy được:
+ Hình a, hình c đều có 3 electron ở lớp vỏ => Hình a, hình c đều có 3 proton => Nguyên tử a, nguyên tử c thuộc cùng 1 nguyên tố hóa học
+ Hình b, hình d đều có 2 electron ở lớp vỏ => Hình b, hình d đều có 2 proton => Nguyên tử b, nguyên tử d thuộc cùng 1 nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
Câu hỏi 1 (trang 16) SGK Hóa 10 Cánh diều Bài 3: Nguyên tử lithium (li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chloride (LiCl) trong đó, Li tồn tại ở dạng ion Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Trả lời:
- Ion Li+ có 3 proton trong hạt nhân.
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
Luyện tập 1 (trang 17) SGK Hóa 10 Cánh diều Bài 3: Phân tử S8 có 128 electron, hỏi số hiệu nguyên tử của lưu huỳnh (S) là bao nhiêu?
Lời giải:
- Phân tử S8 nghĩa là có 8 nguyên tử S
=> 1 nguyên tử S có 128 : 8 = 16 electron
- Nguyên tử trung hòa về điện có số hạt proton = số hạt electron
=> Nguyên tử S có 16 proton
- Mà số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử
=> Nguyên tử S có số hiệu nguyên tử là 16
Luyện tập 2 (trang 17) SGK Hóa 10 Cánh diều Bài 3: Một nguyên tử có Z hạt proton, Z hạt electron và N hạt neutron. Tính khối lượng (gần đúng theo amu) và số khối của nguyên tử này. Nhận xét về kết quả thu được.
Lời giải:
Khối lượng nguyên tử (gần đúng) = khối lượng hạt nhân nguyên tử = Z + N (amu)
Số khối = Z + N
Ta thấy: Khối lượng nguyên tử xấp xỉ bằng số khối
Câu hỏi 2 (trang 17) SGK Hóa 10 Cánh diều Bài 3: Nguyên tử Li có 3 proton, 4 neutron. Viết kí hiệu nguyên tử của nguyên tố này.
Trả lời:
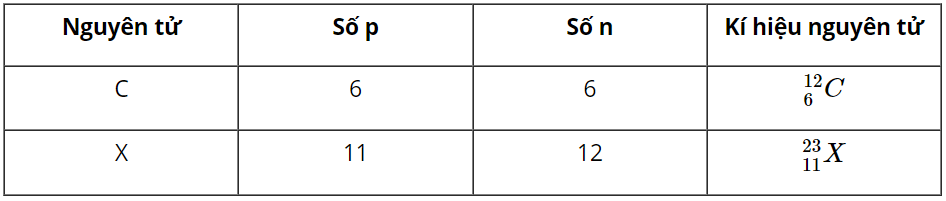
Luyện tập 3 (trang 17) SGK Hóa 10 Cánh diều Bài 3: Hoàn thành bảng sau:
Lời giải:
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Câu hỏi 3 (trang 18) SGK Hóa 10 Cánh diều Bài 3: Cho các nguyên tử sau: . Những nguyên tử nào là đồng vị của nhau?
Trả lời:
- Nguyên tử là đồng vị của nhau vì cùng có 5 proton trong hạt nhân nhưng khác nhau về số neutron (M có 6 neutron còn T có 7 neutron).
Vận dụng 1 (trang 18) SGK Hóa 10 Cánh diều Bài 3: Nguyên tố oxygen có 17 đồng vị, bắt đầu từ , kết thúc là . Các đồng vị oxygen có tỉ lệ giữa số hạt neutron (N) và số hiệu nguyên tử thỏa mãn thì bền vững. Hỏi trong tự nhiên thường gặp những đồng vị nào của oxygen?
Lời giải:
- Trong tự nhiên thường gặp các đồng vị là:
Vận dụng 2 (trang 18) SGK Hóa 10 Cánh diều Bài 3: Em hãy tìm hiểu đồng vị nào của oxygen chiếm tỉ lệ lớn nhất trong tự nhiên.
Lời giải:
Đồng vị của oxygen chiếm tỉ lệ lớn nhất trong tự nhiên.
2. Nguyên tử khối trung bình
Luyện tập 4 (trang 18) SGK Hóa 10 Cánh diều Bài 3: Trong tự nhiên, argon có các đồng vị , , chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Tính nguyên tử khối trung bình của Ar.
Lời giải:
- Nguyên tử khối trung bình của argon là:
Câu hỏi 4 (trang 18) SGK Hóa 10 Cánh diều Bài 3: Chlorine có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,45. Tính tỉ lệ phần trăm số nguyên tử mỗi đồng vị của chlorine trong tự nhiên.
Trả lời:
Gọi x và 100 – x lần lượt là phần trăm số nguyên tử của đồng vị 35Cl và 37Cl
Ta có phương trình:
Suy ra x = 77,5
Vậy tỉ lệ phần trăm số nguyên tử đồng vị 35Cl và 37Cl lần lượt là 77,5% và 22,5%
Bài tập
Bài tập 1 (trang 20) SGK Hóa 10 Cánh diều Bài 3: Hoàn thành bảng sau đây:
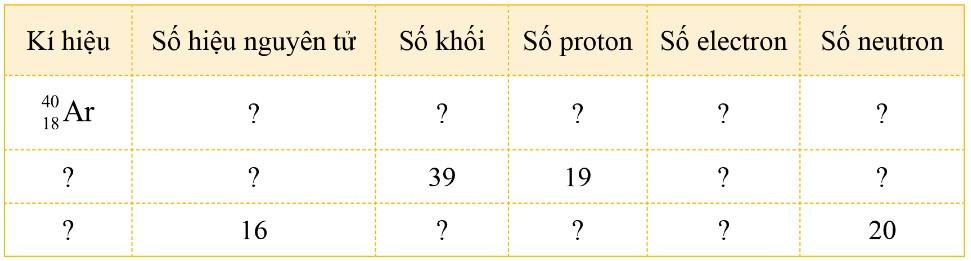
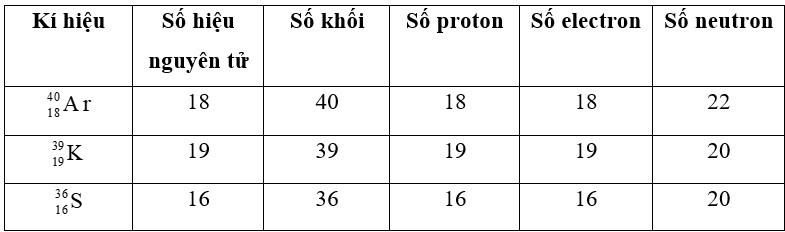
Lời giải:
Bài tập 2 (trang 20) SGK Hóa 10 Cánh diều Bài 3: Những phát biểu nào sau đây là đúng?
(a) Những nguyên tử có cùng số electron thì thuộc cùng một nguyên tố hóa học
(b) Hai ion dương (ion một nguyên tử) có điện tích lần lượt là +2 và +3, đều có 26 proton. Vậy hai ion này thuộc cùng một nguyên tố hóa học
(c) Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học.
(d) Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Lời giải:
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
=> Tất cả nguyên tử của cùng 1 nguyên tố hóa học đều có cùng số proton và cùng số electron.
=> (a) đúng
- Hai ion đều có 26 proton hay đều có số hiệu nguyên tử = 26
=> Hai ion dương này đều thuộc cùng 1 nguyên tố hóa học
=> (b) đúng
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
=> (c), (d) sai
Vậy những phát biểu đúng là: (a) và (b)
Bài tập 3 (trang 20) SGK Hóa 10 Cánh diều Bài 3: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng.
Lời giải:
Số mol đồng là: 0,1 mol
Tỉ lệ phần trăm số nguyên tử của hai đồng vị bền là 63Cu và 65Cu lần lượt là: 73% và 27%.
Vậy số mol hai đồng vị bền là 63Cu và 65Cu lần lượt là: 0,073 mol và 0,027 mol.
Bài tập 4 (trang 20) SGK Hóa 10 Cánh diều Bài 3: Phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở Hình 3.5. Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng 1+).
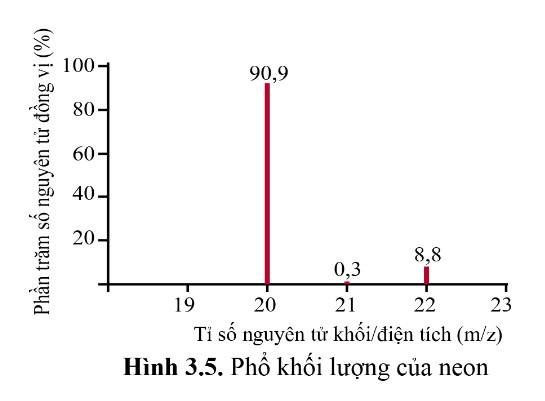
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của neon.
Lời giải:
a) Neon có 3 đồng vị bền: 20Ne(90,9%),21Ne(0,3%),22Ne(8,8%)
b) Nguyên tử khối trung bình của Neon là:
