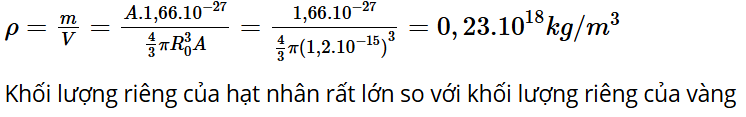Mở đầu: Vào đầu những nãm 1900, các nhà khoa học đã khám phá ra rằng nguyên tử có dạng hình cầu và trung hòa về điện với điện tích âm là các hạt electron. Nhưng người ta chưa biết điện tích dương được phân bố thế nào trong hình cầu nguyên tử. Năm 1904, Joseph John Thomson (Giô-dép Giôn Tôm-xơn) đã đề xuất một mô hình nguyên tử được gọi là mô hình nguyên tử bánh mận (Plum Pudding Atomic Model). Theo mô hình này các electron nằm rải rác trong một hình cầu tích điện dương giống như các quả mận nằm rải rác trong cái bánh (Hình 1.1). Người ta đã kiểm chứng mô hình nguyên tử của Thomson như thế nào?
Lời giải:
Mô hình nguyên tử bánh mận của Joseph John Thomson, đề xuất vào năm 1904, đã được kiểm chứng thông qua một loạt các thí nghiệm điện tử, đặc biệt là thí nghiệm hạt Rutherford.
Thí nghiệm hạt Rutherford: Thí nghiệm hạt Rutherford, được tiến hành bởi Ernest Rutherford vào năm 1909, đã cung cấp bằng chứng rõ ràng nhất cho mô hình nguyên tử bánh mận của Thomson. Trong thí nghiệm này, các hạt alpha (hạt Helium với điện tích dương) được bắn vào một mẫu vật chứa nguyên tử và phát hiện các hạt alpha đã bị phản xạ hoặc hạt alpha đã bị giảm tốc sau khi đi qua mẫu vật. Kết quả cho thấy rằng điện tích dương tập trung ở một vùng nhỏ trong nguyên tử, chỉ phát hiện được từ sự va chạm giữa các hạt alpha và điện tích dương này, trong khi electron phân tán khắp không gian, tương thích với mô hình bánh mận của Thomson.
Những bằng chứng từ thí nghiệm này đã giúp xác nhận và kiểm chứng mô hình nguyên tử bánh mận của Thomson, một bước quan trọng trong việc hiểu về cấu trúc của nguyên tử và phát triển của lý thuyết nguyên tử.
I. Phát hiện ra hạt nhân nguyên tử
Câu hỏi 1: Bằng chứng cụ thể nào trong thí nghiệm tán xạ hạt α của Rutherford chứng tỏ hạt nhân có kích thước rất nhỏ nhưng tập trung toàn bộ điện tích dương và phần lớn khối lượng của nguyên tử?
Lời giải:
- Trong thí nghiệm tán xạ hạt α của Rutherford, các hạt α (hạt Helium với điện tích dương) được bắn vào mẫu vật chứa nguyên tử, trong trường hợp này là một lá vàng mỏng. Khi các hạt α đi qua mẫu vật, một phần chúng bị phản xạ lại, trong khi một phần khác bị giảm tốc và thay đổi hướng do tương tác với các thành phần của nguyên tử, tuy nhiên phần lớn các hạt vẫn đi thẳng và không bị đổi hướng, do đó ông đã kết luận rằng hầu hết khối lượng và tất cả điện tích dương của nguyên tử tập trung ở một vùng nhỏ tại trung tâm của nguyên tử, gọi là hạt nhân.
- Do đó, bằng chứng từ thí nghiệm tán xạ hạt α của Rutherford đã cho thấy rằng hạt nhân có kích thước rất nhỏ nhưng tập trung toàn bộ điện tích dương và phần lớn khối lượng của nguyên tử.
II. Cấu trúc hạt nhân
Luyện tập 1: Hạt nhân có bao nhiêu nucleon, bao nhiêu proton và bao nhiêu neutron?
Lời giải:
- Từ ký hiệu trên ta có số điện tích nguyên tử của ![]() là Z = 30 bằng số proton, tổng số nucleon là A=67 bằng số proton cộng với số neutron, do đó số neutron trong hạt nhân là: N = A – Z = 67 – 30 = 37 hạt.
là Z = 30 bằng số proton, tổng số nucleon là A=67 bằng số proton cộng với số neutron, do đó số neutron trong hạt nhân là: N = A – Z = 67 – 30 = 37 hạt.
Luyện tập 2: Xác định điện tích của hạt nhân
Lời giải:
Điện tích của hạt nhân
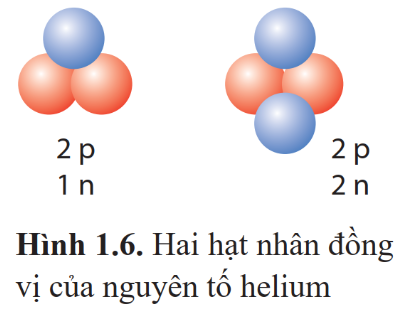
Luyện tập 3: Helium có hai đồng vị mà hạt nhân được biểu diễn như Hình 1.6. Viết kí hiệu hạt nhân của hai đồng vị helium đó.
Lời giải:
Ta thấy hạt nhân của đồng vị số 1 có 2 proton và 1 neutron => Z = 2 và A = 2 +1 = 3, do đó đồng vị này có kí hiệu là: ![]() .
.
Tương tự với hạt nhân của đồng vị số 2 có 2 proton và 2 neutron => Z = 2 và A = 2 + 2 = 4, do đó đồng vị này có kí hiệu là: ![]() .
.
Vận dụng: Hầu hết các nguyên tố đều có nhiều đồng vị. Khối lượng nguyên tử của nguyên tố trong bảng tuần hoàn là khối lượng trung bình của các nguyên tử đồng vị có trong tự nhiên. Nguyên tố chlorine (Cl) có hai đồng vị bền là:
• có khối lượng nguyên tử m = 34,96885 u và chiếm 75,77% chlorine trong tự nhiên.
• có khối lượng nguyên tử m = 36,96590 u và chiếm 24,23% chlorine trong tự nhiên.
Tính khối lượng nguyên tử trung bình của nguyên tố chlorine.
Lời giải:
Khối lượng nguyên tử trung bình:
Tìm hiểu thêm: Nhiều thí nghiệm chứng tỏ rằng hạt nhân (được giả thiết là hình cầu) có bán kính R được cho bởi công thức: (1.1)
Với A là số khối của hạt nhân và R0 = 1,2.10-15 m.
Do đó, thể tích của hạt nhân được tính theo công thức: (1.2)
Công thức (1.2) cho thấy, thể tích hạt nhân tỉ lệ thuận với số khối A.
Biết rằng, khối lượng của mỗi hạt nhân tính theo đơn vị amu xấp xỉ số khối A của nó.
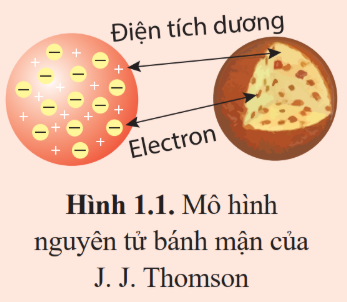
Hãy tính khối lượng riêng của hạt nhân để chứng tỏ rằng hầu hết các hạt nhân đều có khối lượng riêng giống nhau.
So sánh khối lượng riêng của hạt nhân với khối lượng riêng của vàng (1,93.104 kg/m3).
Lời giải:
Khối lượng riêng của hạt nhân: