Mở đầu (trang 39) SGK Hóa 11 Cánh diều Bài 6: Việc lạm dụng sulfur để bảo quản dược liệu, thực phẩm khô,… có thể gây hại đến sức khỏe. Vì sao?
Trả lời:
- Người ta sử dụng sulfur bảo quản dược liệu, thực phẩm khô,… bằng cách đốt cháy lưu huỳnh. Khi đốt sulfur sinh ra khí sulfur dioxdie. Đây là một khí độc, khi tiếp xúc với sulfur dioxdie ở một nồng độ nhất định, cơ thể cảm thấy khó thở, gây ra bệnh viêm đường hô hấp, đau mắt,… Tiếp xúc với SO2 nồng độ cao có thể làm chết người do ngưng hô hấp.
I. Sulfur
Câu hỏi 1 (trang 40) SGK Hóa 11 Cánh diều Bài 6: Trong tự nhiên, nguyên tố sulfur tồn tại ở dạng hợp chất dễ tan hay khó tan trong nước?
- Trong tự nhiên, phần lớn sulfur tồn tại ở dạng hợp chất trong thành phần của các khoáng vật, như pyrite (thành phần chính là FeS2), sphalerite (thành phần chính là ZnS), thạch cao (thành phần chính là CaSO4), barite (thành phần chính là BaSO4), …
Các hợp chất này đều khó tan trong nước.
II. Sulfur dioxide
1. Một số tính chất
Luyện tập 1 (trang 41) SGK Hóa 11 Cánh diều Bài 6: Sulfur dioxide thuộc loại acidic oxide. Hãy cho biết sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide không. Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Lời giải:
Sulfur dioxide có phản ứng được với calcium hydroxide, calcium oxide.
PTHH:
Ca(OH)2 + SO2 → CaSO3↓ + H2O
CaO + SO2 → CaSO3 ↓
Luyện tập 2 (trang 41) SGK Hóa 11 Cánh diều Bài 6: Hãy đề nghị công thức Lewis của SO2.
Lời giải:
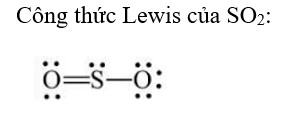
Câu hỏi 2 (trang 42) SGK Hóa 11 Cánh diều Bài 6: Nguyên tử sulfur thể hiện nhiều số oxi hoá khác nhau trong các hợp chất, như – 2, +4, +6. Hãy giải thích vì sao SO2 có cả tính khử và tính oxi hoá.
- Trong hợp chất sulfur dioxide (SO2), nguyên tố sulfur có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, SO2 có thể bị khử hoặc bị oxi hoá.
2. Ứng dụng
Luyện tập 3 (trang 42) SGK Hóa 11 Cánh diều Bài 6: Hoàn thành phương trình hóa học phản ứng đốt cháy FeS2 trong khoáng vật pyrite: FeS2 + O2 → Fe2O3 + (A)
Lời giải:
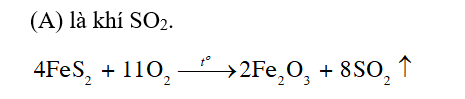
Câu hỏi 3 (trang 42) SGK Hóa 11 Cánh diều Bài 6: Hãy giải thích cơ sở hoá học của một số biện pháp giảm thải lượng sulfur dioxide vào không khí.
- Một số biện pháp giảm thải lượng sulfur dioxide vào không khí và cơ sở hoá học của nó:
+ Thay thế dần các nhiên liệu hoá thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen, … kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
Cơ sở của biện pháp: Giảm nguồn phát sinh khí SO2.
+ Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải ra môi trường.
Cơ sở của biện pháp: Xử lí khí thải trước khi thải ra môi trường.
+ Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống, vôi tôi hoặc đá vôi nghiền…
Cơ sở của biện pháp: Tái chế các sản phẩm phụ có chứa sulfur.
SO2 + CaO → CaSO3;
SO2 + Ca(OH)2 → CaSO3 + H2O …
3. Một số biện pháp giảm thải sulfur dioxide vào khí quyển
Câu hỏi 3 (trang 43) SGK Hóa 11 Cánh diều Bài 6: Hãy giải thích cơ sở hoá học của một số biện pháp giảm thải lượng sulfur dioxide vào không khí.
Trả lời:
Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải khí ra môi trường.
2C + SO2 → 2CO + S
Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống (thành phần chính là CaO), vôi tôi (thành phần chính là Ca(OH)2) hoặc đá với nghiền (thành phần chính là CaCO3).
CaO + SO2 → CaSO3 ↓
Ca(OH)2 + SO2 → H2O + CaSO3↓
CaCO3 + SO2 → CaSO3↓ + CO2
Bài tập
Bài tập 1 (trang 43) SGK Hóa 11 Cánh diều Bài 6: Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Lời giải:

Bài tập 2 (trang 43) SGK Hóa 11 Cánh diều Bài 6: Quá trình hoà tan bột đồng bởi dung dịch sulfuric acid đặc sẽ sinh ra khí sulfur dioxide. Nhằm hạn chế phát tán sulfur dioxide ra môi trường, các hoá chất nào sau đây có thể được dùng để hấp thụ khí này: dung dịch sodium hydroxide, dung dịch nước vôi trong, dung dịch hydrochloric acid? Giải thích.
Lời giải:
Sulfur dioxide là acidic oxide – mang đầy đủ tính chất hoá học của một acidic oxide như tác dụng với nước, basic oxide, base. Do đó nhằm hạn chế phát tán sulfur dioxide ra môi trường, ta có thể dùng dung dịch sodium hydroxide, dung dịch nước vôi trong để hấp thụ khí này.
SO2 + Ca(OH)2 → CaSO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O.
Bài tập 3 (trang 43) SGK Hóa 11 Cánh diều Bài 6: Tại một số nhà máy, người ta dùng calcium oxide (vôi sống) hoặc calcium hydroxide (vôi tôi) để hấp thụ sulfur dioxide trong khí thải.
a) Viết phương trình hoá học của các phản ứng trên.
b) Ở mỗi phản ứng, sulfur dioxide thể hiện tính chất gì?
Lời giải:
a) PTHH:
CaO + SO2 → CaSO3 ↓
Ca(OH)2 + SO2 → H2O + CaSO3↓
b) Ở mỗi phản ứng, sulfur dioxide thể hiện tính chất oxide acid.
