Mở đầu (trang 28) Hóa 12 Kết nối tri thức Bài 6: Tinh bột và cellulose đều là polysaccharide, nhưng chúng đóng những vai trò quan trọng khác nhau trong thực vật và có một số ứng dụng khác nhau trong cuộc sống. Vậy, về cấu tạo và tính chất của tinh bột và cellulose khác nhau như thế nào?
Trả lời:
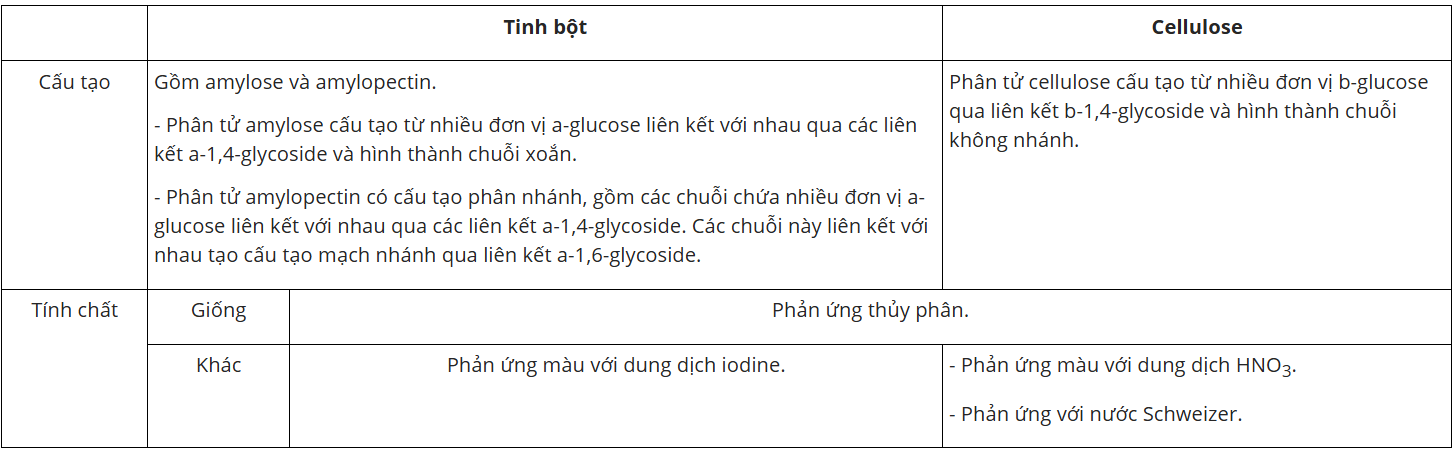
I. Cấu tạo phân tử
Câu hỏi 1 (trang 29) Hóa 12 Kết nối tri thức Bài 6: Cấu tạo của tinh bột và cellulose có những đặc điểm nào khác nhau?
Trả lời:
- Cấu tạo của tinh bột: gồm amylose và amylopectin.
+ Phân tử amylose cấu tạo từ nhiều đơn vị -glucose liên kết với nhau qua các liên kết -1,4-glycoside và hình thành chuỗi xoắn.
+ Phân tử amylopectin có cấu tạo phân nhánh, gồm các chuỗi chứa nhiều đơn vị -glucose liên kết với nhau qua các liên kết -1,4-glycoside. Các chuỗi này liên kết với nhau tạo cấu tạo mạch nhánh qua liên kết -1,6-glycoside.
- Cấu tạo của cellulose: cấu tạo từ nhiều đơn vị -glucose qua liên kết -1,4-glycoside và hình thành chuỗi không nhánh.
II. Tính chất hoá học
1. Tính chất của tinh bột
Hoạt động thí nghiệm 1 (trang 29) Hóa 12 Kết nối tri thức Bài 6: Phản ứng thuỷ phân tinh bột
Chuẩn bị:
Hoá chất: dung dịch hồ tinh bột 1%, dung dịch CuSO4 5%, dung dịch NaOH 10%, dung dịch HCl 1 M, NaHCO3 rắn, nước nóng.
Dụng cụ ống nghiệm, cốc thuỷ tinh, bếp điện.
Tiến hành:
- Cho khoảng 5 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều.
- Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
- Thêm từ từ NaHCO3 vào đến khi ngừng sủi bọt khí.
- Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút.
Quan sát hiện tượng xảy ra và rút ra nhận xét.
Trình bày:

- Nhận xét: Dưới tác dụng của acid, tinh bột bị thuỷ phân tạo thành glucose.
Hoạt động thí nghiệm 2 (trang 29) Hóa 12 Kết nối tri thức Bài 6: Phản ứng màu của hồ tinh bột với iodine
- Chuẩn bị:
+ Hoá chất: dung dịch iodine trong KI, dung dịch hồ tinh bột 1%.
+ Dụng cụ: ống nghiệm, ống hút nhỏ giọt.
- Tiến hành: Lấy 2 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Nhỏ tiếp vài giọt dung dịch iodine vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và rút ra nhận xét.
Trả lời:
- Hiện tượng: Nhỏ vài giọt dung dịch iodine vào ống nghiệm chứa hồ tinh bột, lắc đều, dung dịch nhuốm màu xanh tím.
- Nhận xét: Tinh bột hấp phụ iodine tạo màu xanh tím đặc trưng.
2. Tính chất của cellulose
Hoạt động thí nghiệm 3 (trang 30) Hóa 12 Kết nối tri thức Bài 6: Phản ứng thủy phân cellulose trong môi trường acid
Chuẩn bị:
Hóa chất: cellulose (bông), dung dịch H2SO4 70%, dung dịch NaOH 10%, dung dịch CuSO4 5%, NaHCO3 rắn, nước nóng.
Dụng cụ: ống nghiệm, cốc thủy tinh 250 mL, đũa thủy tinh, đèn cồn, giá đựng ống nghiệm.
Tiến hành:
- Cho 10 mL dung dịch H2SO4 70% vào cốc thủy tinh, thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thủy tinh khuấy đều. Sau đó, đặt cốc thủy tinh vào cốc nước nóng và khuấy trong khoảng 3 phút để cellulose tan hết tạo dung dịch đồng nhất.
- Trung hòa dung dịch bằng cách thêm từ từ NaHCO3 đến khi ngừng sủi bọt khí, sau đó thêm tiếp 5 mL dung dịch NaOH 10%.
- Cho 5 mL dung dịch thu được ở trên vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Đun nóng đều ống nghiệm khoảng 2 phút, sau đó để ống nghiệm trên giá khoảng 3 phút.
Chú ý: Cần thận trọng khi làm việc với dung dịch H2SO4 đặc.
Quan sát hiện tượng xảy ra, giải thích và viết phương trình hóa học.
Trả lời:
- Khi cho bông (cellulose) vào dung dịch H2SO4 đun nóng thì xảy phản ứng thủy phân cellulose tạo thành glucose.
+ PTHH: (C6H10O5)n + nH2O nC6H12O6 (glucose).
- Cho NaHCO3 vào ống nghiệm để NaHCO3 tác dụng với dung dịch H2SO4 còn lại trong ống nghiệm sinh ra khí CO2. Khí ngừng sủi bọt khí chứng tỏ H2SO4 đã phản ứng hết với NaHCO3.
+ PTHH: 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
- Khi cho dung dịch Cu(OH)2 vào ống nghiệm thì glucose sinh ra sau phản ứng thủy phân sẽ hòa tan Cu(OH)2 tạo dung dịch màu xanh lam.
+ PTHH: 2C6H12O6 + Cu(OH)2 → (C6H12O6)2Cu + 2H2O
- Khi đun nóng ống nghiệm thì sau phản ứng thấy xuất hiện kết tủa màu đỏ gạch.
+ PTHH:
CH2OH[CHOH]4CH=O + NaOH + 2Cu(OH)2 CH2OH[CHOH]4COONa + 3H2O + Cu2O.
Câu hỏi 2 (trang 30) Hóa 12 Kết nối tri thức Bài 6: Tại sao tinh bột và cellulose đều có thể dùng để sản xuất ethanol?
Trả lời:
- Dưới tác dụng của enzyme, tinh bột và cellulose bị thủy phân đều tạo glucose. Glucose tiếp tục bị lên men tạo ethanol. Do đó tinh bột và cellulose đều có thể dùng để sản xuất ethanol.
Hoạt động thí nghiệm 4 (trang 30) Hóa 12 Kết nối tri thức Bài 6: Phản ứng của cellulose với nitric acid
Chuẩn bị:
Hoá chất: cellulose (bông), dung dịch HNO3 đặc, dung dịch H2SO4 đặc, dung dịch NaHCO3 loãng, quỳ tím.
Dụng cụ: cốc thuỷ tinh 100 mL, chậu nước nóng, chậu nước đá, đũa thuỷ tinh, giấy lọc, đĩa sứ, đèn cồn.
Tiến hành:
- Cho khoảng 5 mL dung dịch HNO3 đặc vào cốc thuỷ tinh (loại 100 mL) ngâm trong chậu nước đá. Thêm từ từ khoảng 10 mL dung dịch H2SO4 đặc vào cốc và khuấy đều. Sau đó, lấy cốc thuỷ tinh ra khỏi chậu nước đá, thêm tiếp một nhúm bông vào cốc và dùng đũa thuỷ tinh ấn bông ngập trong dung dịch.
- Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
- Ép sản phẩm giữa hai miếng giấy lọc để hút nước và làm khô tự nhiên. Sau đó, để sản phẩm lên đĩa sứ rồi đốt cháy sản phẩm.
Chú ý: Cần thận trọng khi làm việc với dung dịch HNO3 đặc và dung dịch H2SO4 đặc. Quan sát hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Trả lời:
Hiện tượng:
- Miếng bông trên đĩa sứ cháy nhanh, không xuất hiện khói, không để lại tàn.
Giải thích:
Khi đun nóng cellulose với hỗn hợp HNO3 đặc và H2SO4 đặc, tuỳ theo điều kiện phản ứng mà một, hai hay cả ba nhóm hydroxy trong cellulose có thể phản ứng với nitric acid tạo thành cellulose nitrate, cellulose dinitrate hay cellulose trinitrate. Ví dụ:
[C6H7O2(OH)3]n + 3nHNO3 [C6H7O2(ONO2)3]n + 3nH2O
[C6H7O2(OH)3]n + 2nHNO3 [C6H7O2(OH)(ONO2)2]n + 2nH2O
Các hợp chất này cháy nhanh, không xuất hiện khói, không để lại tàn.
Hoạt động thí nghiệm 5 (trang 31) Hóa 12 Kết nối tri thức Bài 6: Tính tan của cellulose trong nước Schweizer
Chuẩn bị:
Hóa chất: cellulose (bông), dung dịch CuSO4 1 M, dung dịch NaOH 20%, dung dịch NH3 đặc.
Dụng cụ: giấy lọc, cốc thủy tinh 250 mL, đũa thủy tinh, ống hút.
Tiến hành:
- Cho khoảng 50 mL dung dịch CuSO4 1 M vào cốc 250 mL. Thêm 20 mL dung dịch NaOH 20% vào, khuấy đều.
- Lọc tách kết tủa, cho vào cốc thủy tinh 250 mL. Thêm khoảng 50 mL dung dịch NH3 đặc, khuấy đều đến khi kết tủa tan hết thu được nước Schweizer.
- Thêm một lượng nhỏ bông vào khoảng 30 mL nước Schweizer và khuấy đều trong khoảng 3 phút.
Quan sát hiện tượng xảy ra, giải thích và viết phương trình hóa học.
Trả lời:
- Khi cho dung dịch NaOH vào dung dịch CuSO4 thì thấy xuất hiện kết tủa xanh.
PTHH: NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Kết tủa màu xanh chính là Cu(OH)2.
- Kết tủa Cu(OH)2 tan trong dung dịch NH3 đặc tạo phức chất có màu xanh lam.
PTHH: Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Phức chất [Cu(NH3)4](OH)2 chính là nước Schweizer.
- Cho bông vào nước Schweizer thì thấy bông tan trong dung dịch.
