Mở đầu
Câu hỏi SGK Hóa 11 Kết nối tri thức Bài 20 (trang 119): Từ xa xưa con người đã biết lên men các loại ngũ cốc, hoa quả để tạo ra các đồ uống có cồn (có chứa ethanol – một alcohol quen thuộc). Ngày nay, alcohol được sử dụng phổ biến trong nhiều lĩnh vực khác nhau như làm dung môi, nguyên liệu hoá học, nhiên liệu, xăng sinh học, … Vậy alcohol là gì và có những tính chất đặc trưng nào?
– Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (-OH) liên kết với nguyên tử carbon no.
* Tính chất đặc trưng của alcohol:
+ Phản ứng với các kim loại mạnh như sodium, potassium … giải phóng khí hydrogen.
+ Phản ứng tạo ether khi đun nóng alcohol với H2SO4 đặc ở khoảng 140 oC.
+ Alcohol no, đơn chức, mạch hở bị tách nước tạo thành alkene.
+ Khi phản ứng với các tác nhân oxi hoá, ví dụ: CuO: alcohol bậc I bị oxi hoá thành aldehyde, alcohol bậc II bị oxi hoá thành ketone, alcohol bậc III không bị oxi hoá trong điều kiện này.
+ Các alcohol đều cháy, khi cháy toả nhiều nhiệt.
+ Ngoài ra, các polyalcohol có các nhóm -OH liền kề, có thể tác dụng với copper(II) hydroxide tạo thành dung dịch màu xanh lam đậm.
* Tính chất hoá học:

I. Khái niệm, danh pháp
Câu hỏi 1 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 120): Viết các đồng phân cấu tạo của alcohol có công thức C4H9OH và xác định bậc của các alcohol đó.
Trả lời:
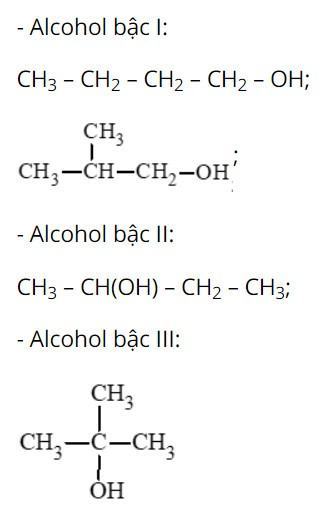
Câu hỏi 2 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 121): Gọi tên theo danh pháp thay thế các alcohol dưới đây:
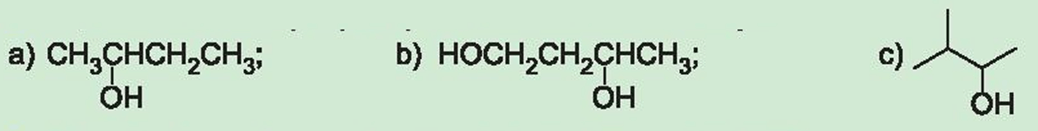
Trả lời:
a) butane-2-ol.
b) butane-1,3-diol.
c) 3-metylbutan-2-ol.
Câu hỏi 3 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 121): Viết công thức cấu tạo của các alcohol có tên gọi dưới đây:
a) pentan – 1 – ol;
b) but – 3 – en – 1 – ol;
c) 2 – methylpropan – 2 – ol;
d) butane – 2,3 – diol.
Trả lời:
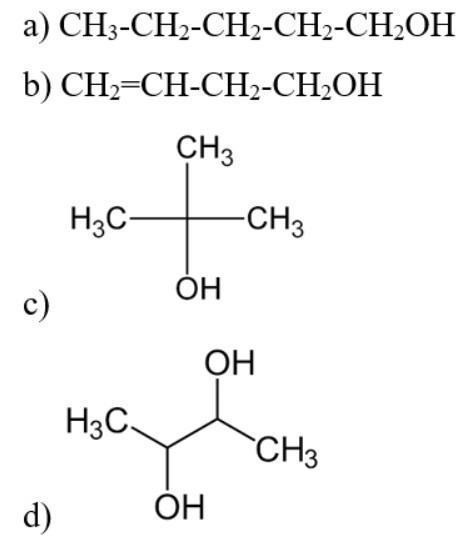
III. Tính chất vật lí
* Hoạt động nghiên cứu SGK Hóa 11 Kết nối tri thức Bài 20 (trang 122): Các hợp chất propane, dimethyl ether và ethanol có phân tử khối tương đương nhau và có một số tính chất như sau:
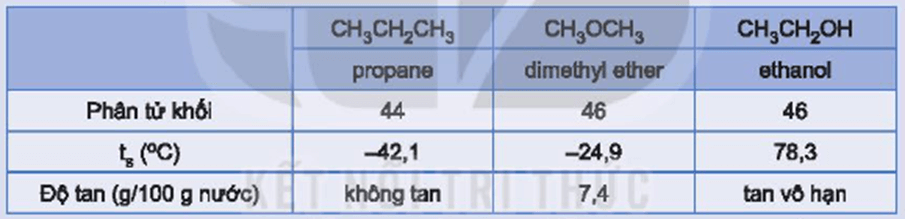
Hãy giải thích tại sao ethanol có nhiệt độ sôi cao hơn và tan trong nước tốt hơn so với hai chất còn lại.
Trả lời:
– Do các phân tử ethanol có thể tạo liên kết hydrogen với nhau và với nước. Vậy nên, dù có phân tử khối tương đương nhau nhưng ethanol có nhiệt độ sôi cao hơn và tan tốt trong nước hơn so với các hợp chất propane và dimethyl ether
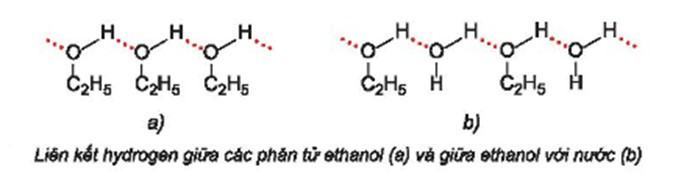
Câu hỏi 4 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 123): Từ số liệu ở Bảng 20.3, em hãy giải thích tại sao trong dãy alcohol no, đơn chức, mạch hở, nhiệt độ sôi của các alcohol tăng dần từ C1 đến C5 còn độ tan trong nước giảm dần từ C3 đến C5.
Trả lời:
– Nhiệt độ sôi tăng dần vì nguyên tử khối tăng dần, độ tan trong nước giảm dần vì số nguyên tử carbon tăng lên (gốc hydrocarbon là phần kị nước).
+ Trong dãy alcohol no, đơn chức, mạch hở nhiệt độ sôi của các alcohol tăng dần từ C1 đến C5 do khối lượng phân tử tăng dần từ C1 đến C5.
+ Trong dãy alcohol no, đơn chức, mạch hở độ tan trong nước giảm dần từ C3 đến C5 do gốc hydrocarbon là phần kị nước tăng lên.
IV. Tính chất hoá học
Câu hỏi 5 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 124): Đun nóng butan – 2 – ol với sulfuric acid đặc thu được các alkene nào? Sản phẩm nào là sản phẩm chính.
Trả lời:
Đun nóng butan – 2 – ol với sulfuric acid đặc thu được các alkene:
(1) CH2 = CH – CH2 – CH3;
(2) CH3 – CH = CH – CH3.
CH3 – CH = CH – CH3 (2) là sản phẩm chính.
Nhóm -OH bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn do phản ứng tách nước của alcohol tạo alkene ưu tiên theo quy tắc Zaisev.
Câu hỏi 6 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 124): Viết công thức cấu tạo sản phẩm của phản ứng khi oxi hoá các alcohol sau bằng CuO đun nóng:
a) CH3OH;
b) CH3CH(OH)CH2CH3.
Trả lời:
a) CH3OH + CuO → HCHO + Cu + H2O
b) 3CH3CH(OH)CH2CH3 + 4CuO → 4CH3COCH3 + 4Cu + 3H2O
* Hoạt động thí nghiệm SGK Hóa 11 Kết nối tri thức Bài 20 (trang 124)
Thí nghiệm 1: Nghiên cứu về phản ứng cháy của alcohol
Chuẩn bị: cồn 90o (cồn y tế), bát sứ, que đóm dài khoảng 20 cm.
Tiến hành: Lấy khoảng 1 mL ethanol (chú ý không lấy nhiều hơn) cho vào bát sứ. Đốt cháy que đóm và đưa ngọn lửa vào gần miệng bát sứ để đốt cháy ethanol.
Lưu ý: Cẩn thận bỏng khi thực hiện thí nghiệm đốt cháy cồn.
Quan sát hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Trả lời:
- Hiện tượng: Que đóm khi được châm lửa đưa vào gần miệng bát sứ cồn (ethanol) đã bắt cháy, cồn cháy mạnh trong không khí và toả nhiều nhiệt, cồn cháy với ngọn lửa màu xanh nhạt.
- Phương trình hoá học minh hoạ:
C2H5OH + 3O2 2CO2 + 3H2O.
Thí nghiệm 2: Copper(II) hydroxide tác dụng với alcohol đa chức
Chuẩn bị: dung dịch CuSO4 2%, dung dịch NaOH 10%, ethanol, glycerol; 2 ống nghiệm.
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống khoảng 1 mL dung dịch CuSO4 2% và 1 mL dung dịch NaOH 10%.
- Lắc nhẹ 2 ống nghiệm rồi nhỏ vào từng ống:
Ống nghiệm (1): 5 giọt ethanol.
Ống nghiệm (2): 5 giọt glycerol.
- Lắc đều cả 2 ống nghiệm.
Quan sát hiện tượng xảy ra ở từng ống nghiệm, giải thích và viết phương trình hoá học.
Trả lời:
Cho vào 2 ống nghiệm, mỗi ống khoảng 1 mL dung dịch CuSO4 2% và 1 mL dung dịch NaOH 10% và lắc nhẹ: Cả 2 ống đều xuất hiện kết tủa xanh lam nhạt (Cu(OH)2
PTHH: CuSO4 + 2NaOH → Cu(OH)2↓(xanh) + Na2SO4
+ Ống nghiệm (1): không có hiện tượng gì xuất hiện.
+ Ống nghiệm (2): Cu(OH)2 tan dần tạo ra dung dịch màu xanh lam nhạt.
PTHH: 2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
Câu hỏi 7 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 125): Viết phương trình hoá học của phản ứng giữa methanol với sodium.
Trả lời:
2CH3OH + 2Na → 2CH3ONa + H2.
Câu hỏi 8 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 125): Nêu phương pháp hoá học để phân biệt methanol và ethylene glycol.
Trả lời:
* Phương pháp thứ nhất:
– Sử dụng copper (II) hydroxide để phân biệt methanol và ethylene glycol.
+ Các polyalcohol có các nhóm -OH liền kề như ethylene glycol có thể tác dụng copper (II) hydroxide tạo dung dịch xanh làm đậm, còn methanol thì không.
* Phương pháp thứ hai:
– Cho lần lượt từng dung dịch tác dụng với Cu(OH)2:
+ Không có hiện tượng xuất hiện → CH3OH.
+ Cu(OH)2 tan dần tạo dung dịch màu xanh lam đậm → ethylene glycol (C2H4(OH)2).
V. Ứng dụng
Câu hỏi 9 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 127): Một đơn vị cồn tương đương 10 mL (hoặc 7,89 gam) ethanol nguyên chất. Theo khuyến cáo của ngành y tế, để đảm bảo sức khoẻ mỗi người trưởng thành không nên uống quá 2 đơn vị cồn mỗi ngày. Vậy mỗi người trưởng thành không nên uống quá bao nhiêu mL rượu 40o một ngày?
Trả lời:
* Cách giải 1:
Áp dụng công thức: Độ rượu =
Thể tích ethanol nguyên chất có trong 2 đơn vị cồn là: 2 × 10 = 20 (mL).
Vậy người trưởng thành không nên uống quá: = =50 ml rượu 40o một ngày.
* Cách giải 2:
- Một đơn vị cồn tương đương 10 mL (hoặc 7,89 gam) ethanol nguyên chất.
→ Hai đơn vị cồn tương đương 20 mL (hoặc 15,78 gam) ethanol nguyên chất.
- Rượu 40° là 100 mL rượu có 40 mL ethanol nguyên chất.
=> Vậy mỗi người trưởng thành không nên uống quá số mL rượu 40° một ngày là: 20 x 100 : 40 = 50 mL
VI. Điều chế
Câu hỏi 10 SGK Hóa 11 Kết nối tri thức Bài 20 (trang 127): Viết phương trình hóa học của các phản ứng trong sơ đồ điều chế glycerol từ proylene.
Trả lời:
CH2=CH-CH3 + Cl2 → CH2=CH-CH2Cl + HCl
CH2=CH-CH2Cl + Cl2 + H2O → CH2Cl-CH(OH)-CH2Cl
CH2Cl-CH(OH)-CH2Cl + 2NaOH → HOCH2-CH(OH)-CH2OH + NaCl
