Mở đầu
Câu hỏi mở đầu: Nguyên tử hydrogen và chlorine dễ dàng kết hợp để tạo thành phân tử hydrogen chloride (HCl), liên kết trong trường hợp này có gì khác so với liên kết ion trong phân tử sodium chloride (NaCl)?
Trả lời:
- Nguyên tử H có 1 electron lớp ngoài cùng, cần 1 electron để đạt cấu hình bền giống He. Nguyên tử Cl có 7 electron lớp ngoài cùng, cũng cần 1 electron để đạt cấu hình bền giống Ne.
=> H và Cl khi liên kết với nhau có xu hướng góp chung electron để xung quanh mỗi nguyên tử đều có số electron đạt cấu hình bền của khí hiếm tạo liên kết cộng hóa trị.
- Trong phân tử NaCl có ion sodium mang điện tích dương, ion chlorine mang điện tích âm nên hình thành liên kết ion.
Vậy liên kết trong phân tử HCl là liên kết cộng hóa trị còn liên kết trong phân tử NaCl là liên kết ion.
I. Sự tạo thành liên kết cộng hóa trị
Hoạt động mục 1: Lắp ráp mô hình một số phân tử
Chuẩn bị: Bộ lắp ráp mô hình các phân tử CH4, C2H4, C2H2, C2H5OH, CH3COOH.
Tiến hành:
- Chọn hình cầu có màu sắc khác nhau đại diện cho nguyên tử C, O, H.
- Lắp các hình cầu và que nối theo mẫu (Hình 12.8).

Quan sát mô hình và cho biết số liên kết đơn, liên kết đôi, liên kết ba trong mỗi phân tử.
Trả lời:
- Phân tử methane có 4 liên kết đơn.
- Phân tử ethene có 4 liên kết đơn + 1 liên kết đôi.
- Phân tử ethyne có 2 liên kết đơn + 1 liên kết ba.
- Phân tử ethanol có 8 liên kết đơn.
- Phân tử ethanoic acid có 6 liên kết đơn + 1 liên kết đôi.
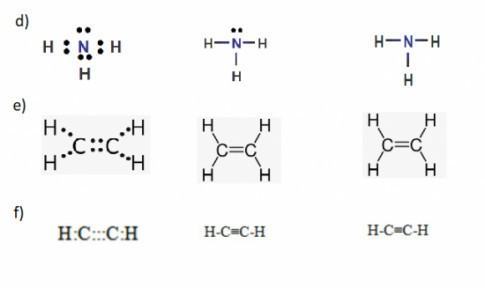
Câu hỏi 1: Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử:
a) Bromine (Br2). b) Hydrogen sulfide (H2S).
c) Methane (CH4) d) Ammonia (NH3)
e) Ethene (C2H4) g) Ethyne (C2H2)
Trả lời:

 II. Độ âm điện và liên kết hóa học
II. Độ âm điện và liên kết hóa học
Câu hỏi 2: Dựa vào giá trị độ âm điện trong Bảng 6.2, dự đoán loại liên kết ( liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử MgCl2, AlCl3, HBr, O2, H2, NH3.
Trả lời:
- Trong phân tử MgCl2, hiệu độ âm điện của Cl và Mg là: 3,16 – 1,31 = 1,85 > 1,7. Vì vậy, liên kết giữa Mg và Cl là liên kết ion.
- Trong phân tử AlCl3, hiệu độ âm điện của Al và Cl: 3,16 – 1,61 = 1,55 ⇒ Liên kết giữa Al và Cl là liên kết cộng hóa trị phân cực.
- Trong phân tử HBr, hiệu độ âm điện của Br và H là: 2,96 – 2,2 = 0,76. Vì vậy, liên kết giữa H và Br là liên kết cộng hóa trị phân cực.
- Trong phân tử O2, hiệu độ âm điện: 3,44 – 3,44 = 0 ⇒ Liên kết giữa O và O là liên kết cộng hóa trị không phân cực.
- Trong phân tử H2, hiệu độ âm điện của H và H là: 2,2 – 2,2 = 0. Vì vậy, liên kết giữa H và H là liên kết cộng hóa trị không phân cực.
- Trong phân tử NH3, hiệu độ âm điện của N và H: 3,04 – 2,2 = 0,84 ⇒ Liên kết giữa N và H là liên kết cộng hóa trị phân cực.
III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
Câu hỏi 3: Sự hình thành liên kết σ và liên kết π khác nhau như thế nào?
Trả lời:
- Liên kết π: trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là sự xen phủ bên.
- Liên kết σ: các orbital xen phủ với nhau theo trục liên kết, gọi là xen phủ trục.
Câu hỏi 4: Số liên kết σ và п có trong phân tử C2H4 lần lượt là
A. 4 và 0.
B. 2 và 0.
C. 1 và 1.
D. 5 và 1.
=> Đáp án D.
Trong phân tử C2H4, có 4 liên đơn kết C – H và 1 liên kết đôi C = C. Vì thế, số liên kết và có trong phân tử C2H4 lần lượt là 5 và 1.
IV. Năng lượng liên kết cộng hóa trị
Câu hỏi 5: Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết điều gì?
Trả lời:
- Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hoá học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết đặc trưng cho độ bền của liên kết.
- Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết: để phá vỡ 1 mol liên kết Cl – Cl thành các nguyên tử Cl (ở thể khí) cần năng lượng là 243 kJ.
Câu hỏi 6: Dựa vào giá trị năng lượng liên kết ở Bảng 12.2, hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2.
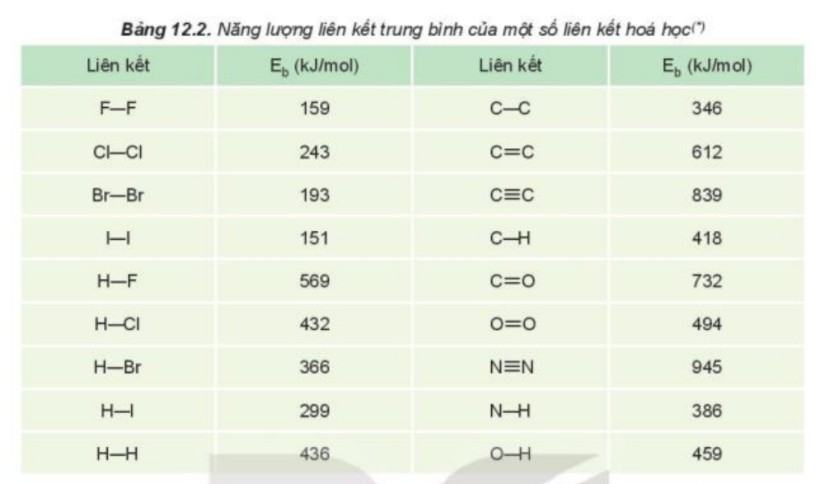
A. I2 > Br2 > Cl2.
B. Br2 > Cl2 > I2.
C. Cl2 > Br2 > I2
D. Cl2 > I2 > Br2.
Trả lời:
Đáp án C.
Năng lượng càng lớn thì liên kết đó càng bền.
