Mở đầu
Câu hỏi mở đầu: Hydrochloric acid được sử dụng rộng rãi trong sản xuất, điển hình là dùng để đánh sạch bề mặt kim loại trước khi gia công, sơn, hàn, mạ điện,… Trong công đoạn này, thép được đưa qua các bể chứa dung dịch HCl (được gọi là bể Picking) để tẩy bỏ lớp rỉ sét, sau đó rửa sạch bằng nước trước khi qua các công đoạn tiếp theo. Vậy các ứng dụng trên dựa vào tính chất quan trọng nào của hydrochloric acid?
Trả lời:
- Khi thép được đưa qua các bể chứa dung dịch HCl để tẩy bỏ lớp rỉ sét
=> Thể hiện tính chất tác dụng với kim loại của hydrochloric acid, cụ thể là tác dụng với kim loại sắt
Fe + 2HCl → FeCl2 + H2
I. Hydrogen halide
Câu hỏi 1: Nêu xu hướng biến đổi độ dài liên kết trong dãy HX.
Trả lời:
- Độ dài liên kết trong dãy HX tăng dần từ HF đến HI.
Câu hỏi 2: Từ bảng 22.2, hãy nhận xét xu hướng biến đổi nhiệt độ sôi của các halogen halide. Giải thích.
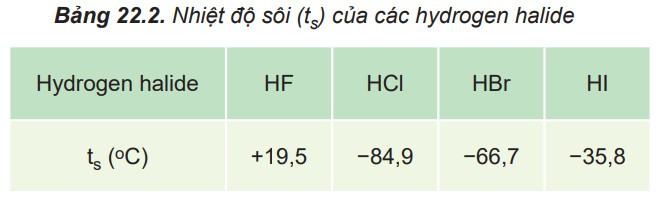
Trả lời:
- Nhiệt độ sôi tăng do: lực tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.
II. Hydrohalic acid
Câu hỏi 3: Ở một nhà máy sản xuất vàng từ quặng, sau khi cho dung dịch chứa hợp chất tan của vàng chảy qua cột chứa kẽm hạt, thu được chất rắn gồm vàng và kẽm. Đề xuất phương pháp thu được vàng tinh khiết.
Trả lời:
Để tách được vàng tinh khiết ra khỏi chất rắn gồm vàng và kẽm, ta dùng dung dịch hydrohalic acid vì hydrohalic acid chỉ hòa tan được kẽm. Sau khi phản ứng hoàn toàn, lọc thu lấy phần chất rắn đem rửa sạch và sấy khô ta thu được vàng tinh khiết.
Zn + 2HCl → ZnCl2 + H2↑
Hoạt động mục 3 (II):
1. Dung dịch HCl tác dụng với kim loại
Chuẩn bị: 2 ống nghiệm, dung dịch HCl loãng, Zn dạng hạt, Cu dạng lá.
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống khoảng 2 mL dung dịch HCl loãng.
- Cho vài hạt Zn vào ống (1), vài lá Cu vào ống (2).
Quan sát hiện tượng và viết phương trình hoá học.
Trả lời:
Hiện tượng:
- Ống (1): hạt Zn tan dần và có bọt khí thoát ra.
- Ống (2): không hiện tượng gì.
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2↑
2. Dung dịch HCl tác dụng với muối NaHCO3 rắn
Chuẩn bị: dung dịch HCl loãng, muối NaHCO3 rắn, ống nghiệm
Tiến hành:
Cho thìa nhỏ NaHCO3 vào ống nghiệm, thêm tiếp dung dịch HCl loãng
Quan sát hiện tượng và trả lời câu hỏi:
1. Viết phương trình hóa học của phản ứng
2. So sánh tính acid của HCl và H2CO3
Trả lời:
Xuất hiện bọt khí không màu – CO2
1. Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
2. Tính acid của HCl mạnh hơn H2CO3 vì carbonic acid bị acid HCl đẩy ra khỏi muối.
Câu hỏi 4: Viết phương trình hóa học khi cho dung dịch hydrochloric acid lần lượt tác dụng với Fe, MgO, Cu(OH)2, AgNO3.
Trả lời:
Fe + HCl → FeCl2 + H2
MgO + 2HCl → MgCl2 + H2O
Cu(OH)2 + 2HCl → CuCl2 + H2O
AgNO3 + HCl → AgCl + HNO3
Câu hỏi 5: Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate bám trên bề mặt kim loại trước khi sơn, hàn, mạ điện. Ứng dụng này dựa trên tính chất hóa học nào của hydrochloric acid?
Trả lời:
- Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate vì
+ HCl tác dụng với oxide, hydroxide → Muối + H2O
+ HCl tác dụng với muối carbonate → Muối mới + CO2 + H2O
III. Muối halide
Hoạt động mục 2 (III): Nhận biết ion halide
Chuẩn bị: 4 ống nghiệm; các dung dịch: AgNO3, NaF, NaCl, NaBr, NaI.
Tiến hành:
- Cho 2 mL mỗi dung dịch NaF, NaCl, NaBr, NaI vào từng ống nghiệm.
- Nhỏ vài giọt dung dịch AgNO3 vào mỗi ống nghiệm.
Quan sát hiện tượng và và thực hiện yêu cầu sau:
1. Viết phương trình hóa học các phản ứng xảy ra.
2. Nêu cách nhận biết dung dịch muối halide bằng dung dịch AgNO3.
Trả lời:
1. Phương trình hóa học:
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + NaBr → AgBr↓ + NaNO3
AgNO3 + NaI → AgI↓ + NaNO3
2. Cách nhận biết dung dịch muối halide
- Cho dung dịch AgNO3 vào 4 ống nghiệm chứa 4 dung dịch muối halide (từ F đến I)
+ Ống không có hiện tượng gì thì đó là muối F-
+ Ống có kết tủa trắng thì đó là muối Cl-
+ Ống có kết tủa vàng nhạt thì đó là muối Br-
+ Ống có kết tủa vàng thì đó là muối I-
Câu hỏi 6: Cho biết vai trò của NaBr và NaI khi tham gia phản ứng với sulfuric acid đặc.
Trả lời:
- NaBr khử sulfuric acid đặc thành sulfur dioxide và NaI khử được sulfuric acid đặc thành hydrogen sulfide.
Câu hỏi 7: Vì sao không dùng trực tiếp nước biển làm nước uống, nước tưới cây?
Trả lời:
– Nước biển rất mặn. Việc uống quá nhiều muối vào cơ thể sẽ khiến cho chúng ta mất nhiều nước hơn để thải chính lượng muối đó ra ngoài, ảnh hưởng đến sức khỏe trong cơ thể đặc biệt là thận, mà thận người chỉ có thể điều tiết lượng muối trong cơ thể ở mức 0,9% trong khi nước biển có nồng độ muối ăn khá cao từ 3,1 – 3,5%.
Câu hỏi 8: Nước muối sinh lí thường chia làm hai loại: loại dùng để tiêm truyền tĩnh mạch và loại dùng để nhỏ mắt, nhỏ mũi, súc miệng, rửa vết thương.
a) Loại nào cần vô trùng tuyệt đối và phải dùng theo chỉ định của bác sĩ?
b) Để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần bao nhiêu gam muối ăn?
Trả lời:
a)
– Nước muối sinh lí dùng để tiêm vào mạch máu, tiêm vào bên trong cơ thể người nên cần phải cần phải vô trùng tuyệt đối và dùng theo chỉ định của bác sĩ.
– Không cần vô trùng tuyệt đối nước muối để nhỏ mắt, nhỏ mũi, súc miệng, rửa vết thương vì những loại nước này không đưa vào bên trong cơ thể người, thường để loại bỏ chất bẩn chứ không có tác dụng sát khuẩn.
b)
– 1L nước cất tương đương với 1 kg
– Vì nồng độ muối thấp nên có thể coi 1L dung dịch muối = 1 kg = 1000g
Ta có: 0,9% Khối lượng muối / khối lượng dung dịch x 100% Khối lượng muối / 1000 x 100% = 9g
Vậy để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần 9 gam muối ăn. Nước muối (natri clorid) được pha chế với tỷ lệ 0,9%, tức 1 lít nước với 9g muối tinh khiết, được gọi là nước muối sinh lý và dùng được cho mọi lứa tuổi.
