I. Hệ thống hóa kiến thức
Trả lời:
(1) một hay nhiều cặp electron dùng chung.
(2) liên kết đơn
(3) liên kết đôi
(4) liên kết ba
(5) không bị hút lệch về phía nguyên tử nào
(6) CO2
(7) hút lệch về phía nguyên tử có độ âm điện lớn hơn.
(8) HCl
(9) chuyển hẳn đến nguyên tử nhận electron tạo thành ion âm và nguyên tử nhường electron tạo thành ion dương.
(10) NaCl
(11) tinh thể ion
(12) NaCl
(13) các ion dương và âm sắp xếp tại các nút của mạng tinh thể ion theo trật tự luân phiên, liên kết bằng lực hút và lực đẩy.
(14) nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn)
II. Luyện tập
Câu hỏi 1: Dãy các chất nào dưới dây mà tất cả các phân tử đều có liên kết ion?
A. Cl2, Br2, I2, HCl.
B. Na2O, KCl, BaCl2, Al2O3.
C. HCl, H2S, NaCl, N2O
D. MgO, H2SO4, H3PO4, HCl.
Đáp án: B. Na2O, KCl, BaCl2, Al2O3.
Giải thích
A. loại do liên kết trong Cl2 là liên kết cộng hóa trị.
C. loại do liên kết trong HCl là liên kết cộng hóa trị.
D. loại do liên kết trong HCl là liên kết cộng hóa trị.
Câu hỏi 2: Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
A. N2, CO2, Cl2, H2.
B. N2, Cl2, H2, HCl.
C. N2, Hl, Cl2, CH4.
D. Cl2, O2, N2, F2.
Đáp án: D. Cl2, O2, N2, F2.
Giải thích:
- Liên kết cộng hóa trị không phân cực là loại liên kết trong các đơn chất.
Câu hỏi 3: Viết công thức cấu tạo và công thức Lewis của các phân tử sau: PH3, H2O, C2H6. Trong phân tử nào có liên kết phân cực mạnh nhất?
Trả lời:
Công thức cấu tạo Lewis của các phân tử PH3, H2O, C2H6 lần lượt là:
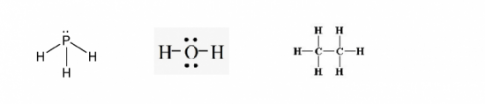
=> Phân tử có liên kết phân cực mạnh nhất: H2O.
Câu hỏi 4: Dựa vào giá trị độ âm điện của các nguyên tử trong bảng 6.2, xác định loại liên kết trong phân tử các chất: CH4, CaCl2, HBr, NH3.
Trả lời:
- Hiệu độ âm điện của C và H là 2,55 – 2,2 = 0,35 nên liên kết C - H trong phân tử CH4 là liên kết cộng hóa trị không phân cực.
- Hiệu độ âm điện của Cl2 và Ca là 3,16 – 1,1 = 2,06 nên liên kết Ca – Cl trong phân tử CaCl2 là liên kết ion.
- Hiệu độ âm điện của Br và H là 2,96 – 2,2 = 0,76 nên liên kết H – Br trong phân tử HBr là liên kết cộng hóa trị phân cực .
- Hiệu độ âm điện của N và H là 3,04 – 2,2 = 0,84 nên liên kết N – H trong phân tử NH3 là liên kết cộng hóa trị phân cực.
Câu hỏi 5: Cho dãy các oxide sau Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a) Độ phân cực của các liên kết trong dãy các oxide trên thay đổi thế nào?
b) Dựa vào giá trị độ âm điện của các nguyên tố trong Bảng 6.2, cho biết loại liên kết (ion, cộng hoá trị phân cực, cộng hóa trị không phân cực) trong từng phân tử oxide.
Trả lời:
a) Độ phân cực trong dãy oxide giảm dần theo chiều từ trái sang phải do hiệu độ âm điện giảm dần: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
b) Na2O, MgO, Al2O3: liên kết ion
SiO2, P2O5: liên kết cộng hóa trị phân cực.
SO3, Cl2O7: liên kết cộng hóa trị không phân cực.
Câu hỏi 6:
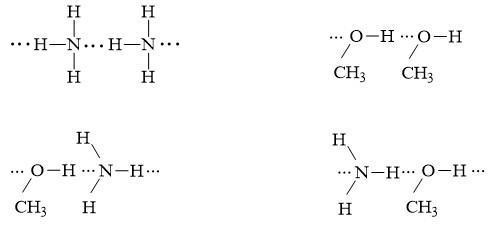
a) Cho dãy các phân tử C2H6, CH3OH, NH3. Phân tử nào trong dãy có thể tạo liên kết hydrogen? Vì sao?
b) Vẽ sơ đồ biểu diễn liên kết hydrogen giữa các phân tử đó?
Trả lời:
a) Liên kết hydrogen được hình thành dựa trên hai điều kiện:
- Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,…
- Nguyên tử F, O, N…. liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
Phân tử có thể tạo liên kết hydrogen là CH3OH, NH3 do O và N còn cặp electron hóa trị chưa tham gia liên kết.
b) Sơ đồ biểu diễn liên kết hydrogen giữa các phân tử: